Biên tập: TS.BS Trần Ngọc Tuấn
Vào năm 2019, Victoria Grey, một bà mẹ 4 con, 34 tuổi đến từ Forest, MS, ngồi trong một căn phòng tại Viện Nghiên cứu Sarah Cannon ở Nashville. Một túi đông lạnh chứa các tế bào máu đã được chỉnh sửa gen của cô ấy đang rã đông bên cạnh giường của cô ấy.
Khi Victoria được 3 tháng tuổi, bà ngoại vội đưa cô đi cấp cứu. Tại đây, các bác sĩ chẩn đoán Gray mắc bệnh hồng cầu hình liềm (SCD), một chứng rối loạn máu làm tổn thương
các cơ quan chính và gây ra những cơn đau dữ dội suốt đời.
SCD là kết quả của đột biến gen HBB. Thay vì tạo ra một thành phần protein gọi là beta-globin để vận chuyển oxy, cơ thể tạo ra một phiên bản bất thường gọi là hemoglobin S. Các tế bào hồng cầu chuyển thành hình lưỡi liềm và dính. Những chiếc gai sắc nhọn làm kẹt và cắt đứt niêm mạc của các mạch máu, đồng thời có thể gây ra các cơn đau tim và đột quỵ, ngay cả ở trẻ em. Mẹ của Victoria đã được cảnh báo rằng con gái bà có thể không sống qua sinh nhật thứ 6 của mình.
Victoria bị di truyền căn bệnh của mình từ cha mẹ cô. Nó được di truyền qua các gen tế bào hình liềm lặn từ mẹ và bố. Bất kỳ đứa trẻ nào được sinh ra bởi hai người mang gen dị tật nhưng không bị SCD đều có 25% khả năng mắc bệnh này. Nếu cả cha và mẹ đều bị SCD, tất cả con cái của họ cũng sẽ như vậy. Căn bệnh này chủ yếu tấn công những người có nguồn gốc châu Phi, nơi gen tế bào hình liềm được cho là có tác dụng bảo vệ chống lại bệnh sốt rét ác tính.
Bây giờ, Victoria đã sẵn sàng để thoát khỏi nghiệp đột biến DNA đó một cách tốt đẹp. Cô ấy sắp trở thành một người tiên phong trong ngành y tế.
Kéo phân tử
Vài tuần trước đó, bác sĩ của Victoria, Tiến sĩ Frangoul, giám đốc chuyên môn về huyết học nhi khoa tại Viện nghiên cứu Sarah Cannon, đã chiết xuất hàng tỷ tế bào gốc của cô và gửi chúng đến một phòng thí nghiệm bí mật không được tiết lộ ở châu Âu. Ở đó, các xung điện được áp dụng để cạy mở tạm thời các kênh vận chuyển trên màng tế bào của cô ấy. Sau đó, “chiếc kéo phân tử” được đưa vào qua lối vào này nhằm cố gắng sửa mã di truyền bị xáo trộn của cô ấy. Các tế bào được tái thiết kế đã được giữ đông lạnh và chuyển trở lại Nashville.
Các tế bào máu hiện đã rã đông, bác sĩ Frangoul đẩy pít-tông của một ống tiêm vào đường trung tâm dẫn đến ngực của Victoria. Các tế bào được truyền bắt đầu sản sinh ra một dạng hemoglobin lành mạnh hơn. Việc truyền dịch này sẽ giúp Victoria thoát khỏi những cơn đau suốt đời và những cơn đau tim, vào những năm đầu tuổi 30, cô phải nhập viện 2 tháng 1 lần.
Kỹ thuật nối được sử dụng để ghi đè mã bộ gen gây ra bệnh của Victoria là CRISPRCas9. Đó là một phiên bản đơn giản hơn, rẻ hơn và chính xác hơn của các công nghệ chỉnh sửa gen xuất hiện vào thập niên 90 tuy được quảng cáo rầm rộ nhưng không làm được.
CRISPR cho phép các nhà khoa học xóa hoặc viết lại các đột biến trong DNA. Nó có thể mở đường để loại bỏ một loạt các bệnh di truyền, từ hội chứng Down và xơ nang đến chứng khó đọc và mù lòa.
CRISPR “cho phép bạn thay đổi bản vẽ thiết kế của sự sống cho bất kỳ sinh vật nào bạn muốn” Tiến sỹ Eric Olson, nhà sinh học phân tử, Đại học Texas, cho biết
Về lý thuyết, CRISPR cũng có thể được sử dụng – thậm chí cả trong phôi thai – trên các vùng cụ thể của nhiễm sắc thể để tùy chỉnh các đặc điểm thể chất, tinh thần và phân tử của một người. Ví dụ, nó có thể cho phép chọn màu tóc hoặc mắt của một đứa trẻ chưa chào đời. Và CRISPR có thể quyết định mức độ thông minh hoặc nguy cơ tự kỷ, cả hai đều là kết quả của sự tác động lẫn nhau phức tạp giữa di truyền và môi trường.
Nhưng đối với Victoria, CRISPR chỉ đơn giản mang lại hy vọng. Việc cô tìm kiếm phương
pháp cấy ghép tủy xương – một phương pháp mạo hiểm và cho đến nay, là phương pháp chữa trị duy nhất cho SCD – đã không có kết quả. Sau đó, Tiến sĩ Frangoul tiếp cận cô ấy với một đề xuất: hãy trở thành một trong những người đầu tiên trên thế giới thử liệu pháp thử nghiệm này.
Frangoul nói: “Chúng tôi không biết chắc liệu nó có hoạt động hay không”. Cô ấy nói, “Đăng ký cho tôi”.
Cách CRISPR hoạt động
Khoảng một thập kỷ trước, Tiến sỹ Jennifer A. Doudna, đang nghiên cứu vi khuẩn trong đĩa nuôi cấy khi cô tìm cách giải mã cách chúng chống lại virus. Cụ thể, chuyên gia hóa sinh này phát hiện ra rằng những vi sinh vật này và các vi sinh vật khác bảo vệ chống lại nhiễm trùng bằng cách ghi nhớ chuỗi DNA của những kẻ xâm lược trước đó để khi chúng quay trở lại, hệ thống miễn dịch sẽ được chuẩn bị để tiêu diệt chúng.
CRISPR là từ viết tắt của Clustered Regular Interspaced Short Palindromic Repeats, là một phần của hệ thống miễn dịch chống lại vi khuẩn đó. “Palindromic” có nghĩa là một đoạn trình tự đọc tiến về phía trước hay đọc lùi về phía sau đều giống nhau.
Để tạo ra bức ảnh chụp gen đó, vi khuẩn đánh cắp các đoạn mã gen của kẻ xâm nhập được gọi là “spacer” – bộ đệm. Sau đó, chúng ghép chúng vào DNA của chính chúng, các đoạn spacer và các đoạn lặp lại, và bắt đầu tạo ra RNA chuỗi đơn. Các chuỗi ngắn CRISPR RNA đó hoạt động như một kẻ dẫn đường đến nhà của trình tự virus phù hợp khi nó bị phát hiện. Một công cụ khác của bộ máy CRISPR, một loại enzyme có tên là Cas9, cắt vi rút và tiêu diệt nó để nó không thể nhân lên.
Năm 2012, Doudna, một giáo sư tại Đại học California, Berkeley, đã xuất bản một bài báo đột phá mô tả phương pháp điều trị này, đưa CRISPR vào một thế giới y khoa rộng lớn.
CRISPR được biết đến từ năm 1987, khi các nhà khoa học Nhật Bản phát hiện ra một “chuỗi DNA lặp lại bất thường” ở vi khuẩn E. coli. Nhưng chính Doudna là người đã bẻ khóa mã hóa để biến CRISPR thành một công cụ hack có thể sửa lỗi “chính tả” trong bộ gen một cách dễ dàng như với các từ trong một câu.
Tiến sỹ Eric Olson, nhà sinh học phân tử tại Đại học Texas, người đang phát triển phương pháp điều trị chứng loạn dưỡng cơ dựa trên CRISPR cho biết: “Nó cho phép bạn thay đổi bản vẽ thiết kế của sự sống cho bất kỳ sinh vật nào bạn muốn.
Vào năm 2020, Tiến sĩ Doudna và Emmanuelle Charpentier, hiện là giám đốc Đơn vị Max Planck cho Khoa học về Tác nhân gây bệnh ở Berlin, đã cùng giành giải Nobel Hóa học cho công trình “viết lại mã sự sống”.
CRISPR – hiện tại và tương lai
Cho đến nay, các nhà sinh học đã sử dụng CRISPR để tạo ra những con dê béo hơn với lông dài hơn để mang lại nhiều thịt và len hơn; bảo vệ vi khuẩn được sử dụng để làm pho mát và sữa chua khỏi nhiễm virus; đánh bật gen cafein trong cây cà phê; và nuôi “lợn siêu nhỏ” cho vật nuôi nặng khoảng 30 pound, không lớn hơn nhiều so với một con chó cỡ trung bình như chó sục Ireland.
Vào tháng 11 năm 2018, một nhà khoa học Trung Quốc tên là He Jiankui đã tải lên YouTube một video và thông báo về sự ra đời của những con người được chỉnh sửa CRISPR đầu tiên trên thế giới. Anh ta tuyên bố anh ta đã chỉnh sửa phôi thai của các bé gái sinh đôi để kháng lại HIV, một căn bệnh mà ở Trung Quốc vẫn còn bị kỳ thị sâu sắc. Các phôi được cấy lại trong tử cung của người mẹ.
Phản ứng nhanh như chớp. Các nhà khoa học kêu gọi trên toàn thế giới ngừng sử dụng
CRISPR trực tiếp trên phôi, trứng hoặc tinh trùng để tạo ra những đứa trẻ biến đổi gen.
Cho đến nay, trong khi nhiều quốc gia cấm thực hành, vẫn chưa có lệnh cấm quốc tế
nào như vậy tồn tại. Một tòa án Trung Quốc đã kết án He 3 năm tù.
Nhưng không lâu trước khi một nhà khoa học khác, lần này ở Nga, bắt đầu nói với các phóng viên rằng ông muốn sử dụng một kế hoạch chỉnh sửa phôi thai tương tự để cho
phép các cặp vợ chồng mang gen điếc bẩm sinh sinh con với thính giác bình thường.
Bác sỹ Andreas Lauer đã chỉnh sửa các đột biến gen CEP290 để khôi phục thị lực ở một bệnh nhân mắc chứng mù di truyền hiếm gặp. Quy trình vào tháng 3 năm 2020 là lần
đầu tiên sử dụng CRISPR trực tiếp vào cơ thể người.
Vấn đề nan giải mà cộng đồng khoa học phải đối mặt trước tiềm năng to lớn của CRISPR là một trong những vấn đề đạo đức. Đâu là ranh giới giữa việc loại bỏ đau khổ của con người và thao túng – không thể thay đổi và không để lại hậu quả – cấu tạo di truyền của các thế hệ tương lai?
Kỹ thuật mà nhà khoa học He sử dụng với cặp song sinh người Trung Quốc được gọi là chỉnh sửa “germline” – dòng mầm. Nó được thực hiện trên phôi và kết quả là sửa đổi vĩnh viễn DNA và có thể di truyền được.
Ngoài ra, vào năm 2020, các bác sĩ ở Oregon đã nhỏ chất lỏng được nhúng bằng công
cụ CRISPR vào võng mạc của một người trưởng thành mắc một loại mù di truyền hiếm
gặp. Thuốc nhỏ mắt được thiết kế để sửa chữa một gen có tên là CEP290 để phục hồi
thị lực. Trẻ em và người lớn bị mù trên khắp thế giới đang chờ đợi kết quả sơ bộ, sẽ
ra mắt vào cuối năm nay.
Đó là lần đầu tiên các bác sĩ sử dụng CRISPR bên trong cơ thể người sống, hay còn gọi là chỉnh sửa gen “in vivo”. Bệnh nhân vẫn mang gen mù, vì vậy có thể những đứa con trong tương lai của họ sinh ra sẽ không có thị lực.
Có thể cho rằng, CRISPR là một phương tiện để đạt được mục tiêu hợp lý: sửa chữa, chữa khỏi hoặc đảo ngược các đột biến di truyền gây ra bệnh tật hoặc thay đổi cuộc sống.Các liệu pháp gen cũ hầu hết đều điều trị các bệnh. Nhưng CRISPR đưa ra một lời hứa căng thẳng hơn nhiều: khả năng loại bỏ các bệnh di truyền khỏi nguồn gen.
Tương lai đó có thể đi kèm với những hậu quả không mong muốn, được gọi là “hiệu
ứng ngoài mục tiêu”. “Một câu hỏi đạo đức cần đặt ra trong nghiên cứu là, ai là người chịu rủi ro và lợi ích của một công nghệ mới?” Tiến sỹ, Insoo Hyun, giám đốc đạo đức nghiên cứu tại Trung tâm Đạo đức Sinh học tại Trường Y Harvard cho biết. “Trong trường hợp chỉnh sửa dòng mầm, lợi ích có thể dành cho cặp vợ chồng, nhưng rủi ro sẽ đến với thai nhi, và
có thể là con cháu của họ.”
“Về phương diện triết học, chúng ta thực sự muốn đi xuống con đường đó sao?” Trên
thực tế, chúng tôi đã có.
Người ta đã chứng minh trên chuột rằng CRISPR có thể hạn chế các triệu chứng của
hội chứng nhiễm sắc thể X dễ gãy, một nguyên nhân di truyền của bệnh tự kỷ có thể
dẫn đến nhạy cảm nghiêm trọng với ánh sáng và âm thanh cũng như các hành vi ám
ảnh và lặp đi lặp lại.
CRISPR cũng đã chữa khỏi cho những chú chó mắc chứng loạn dưỡng cơ Duchenne,
một căn bệnh suy giảm cơ bắp hiếm gặp mà ở người hầu hết chỉ ảnh hưởng đến các
bé trai.
Ít ai có thể lường trước được tương lai đó lại háo hức hơn những bậc cha mẹ của những
đứa trẻ bị bệnh bẩm sinh tàn phá.
CRISPR: có phải là một công cụ chữa trị hữu ích cho tương lai hay không?
Debra, nhìn thấy con trai Hawken Miller, 4 tuổi, khóc trong lúc tập bóng đá. Hawken trông có vẻ bất hợp tác. Miller đưa con trai đến gặp bác sĩ nhi khoa chia sẻ những hoài nghi của mình, tin rằng có điều gì đó không ổn rất nghiêm trọng.
Phải mất một năm, các bác sĩ mới chẩn đoán Hawken mắc chứng loạn dưỡng cơ Duchenne. Căn bệnh thoái hóa này bắt nguồn từ một đột biến ở gen lớn nhất trong cơ thể người, gen dystrophin. Bé trai mắc bệnh Duchenne chào đời khỏe mạnh. Nhưng bởi vì chúng thiếu một loại protein quan trọng hoạt động như một chất giảm xóc cho cơ, các sợi cơ của trẻ bắt đầu bị phá vỡ vào khoảng tuổi mẫu giáo.
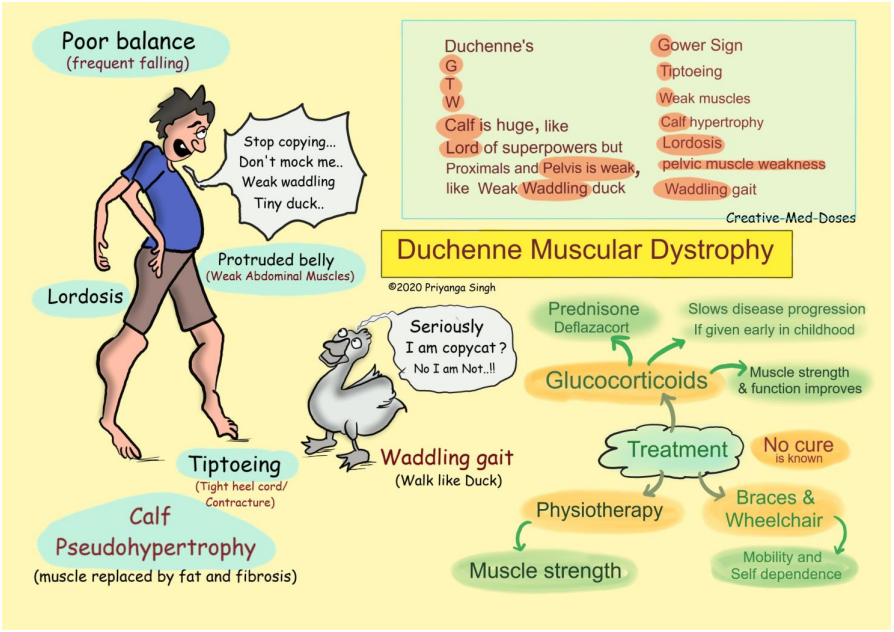
Căn bệnh này không thể chữa khỏi. Đến cấp hai, nhiều đứa trẻ không thể đi được nữa. Đến tuổi trưởng thành, chúng thường cần máy thở để thở. Năm nay 24 tuổi, Hawken là một nhà báo làm việc cho tạp chí sức khỏe, sống độc lập ở Los Angeles. Anh ấy phải ngồi xe lăn, ngủ với máy thở và uống hai loại thuốc mỗi ngày để điều trị suy tim. Tuổi thọ trung bình của nam giới với Duchenne là dưới 30 năm.
Debra Miller thành lập nhóm CureDuchenne, ngay sau khi con trai cô được chẩn đoán.
Nhóm này gần đây đã hợp tác với Olson, nhà sinh học phân tử của Đại học Texas, với 2 triệu USD tiền tài trợ để thành lập một công ty khởi nghiệp nhằm tìm ra phương pháp chữa bệnh dựa trên CRISPR.
Trong một thử nghiệm gần đây, nhóm của Olson đã tiêm một loại virus vô hại có chứa bộ máy CRISPR vào tế bào cơ của sáu con chó có gen Duchenne. Enzyme bắt đầu cắt ở exon 51 của gen. Trong vòng vài tuần, những con chó bắt đầu sản xuất protein bị thiếu.
Có thể trong vòng vài năm, không phải vài thập kỷ, những đứa trẻ mới được chẩn đoán mắc bệnh Duchenne có thể ngăn chặn bệnh của chúng chỉ bằng một lần truyền tĩnh mạch. Thật không may, CRISPR sẽ không thể đảo ngược tổn thương cơ đã xuất hiện trước đó.
Một lời hứa được thực hiện
Gần 2 năm đã trôi qua kể từ khi Victoria Grey điều trị bệnh hồng cầu hình liềm. Các tế bào gốc đã được chỉnh sửa của Vic đã bắt rễ trong tủy xương của cô ấy và tạo ra hemoglobin khỏe mạnh sống lâu hơn hemoglobin hình liềm của cô ấy. Và các triệu chứng của cô ấy đã biến mất.
Liệu một ngày nào đó CRISPR có thể được sử dụng để chỉnh sửa gen tế bào hình liềm trong phôi, đảm bảo rằng ngay từ đầu sẽ không có đứa trẻ nào sinh ra mắc bệnh? Victoria, người có cuộc đời trải qua hàng loạt lần truyền máu, vào phòng cấp cứu và đau đớn trước CRISPR, đang tận hưởng cuộc sống đơn giản bình thường – nhưng đối với cô, là cuộc sống như trong tiểu thuyết.
“Tôi có thể làm những điều cho bản thân và cho gia đình mà trước đây tôi không thể làm được, như xem con gái tôi nhảy cổ động, xem các trận bóng đá của con trai tôi, và cứ sống và tận hưởng cuộc sống”, cô nói. “Tôi bây giờ có hy vọng.”
Nguồn tham khảo:
MedlinePlus: “HBB gene,” “Is eye color determined by genetics?” “Autism spectrum
disorder,” “Is hair color determined by genetics?” “Is intelligence determined by
genetics?”
National Human Genome Research Institute: “Sickle Cell Disease.”
American Society of Hematology: “Sickle Cell Disease.”
Muscular Dystrophy Association: “About Neuromuscular Diseases.”
CDC: “Data & Statistics on Sickle Cell Disease.”
Columbia University Irving Medical Center: “Study Identifies Pitfall for Correcting Mutations in Human Embryos with CRISPR.
Harvard University Graduate School of Arts and Sciences: “CRISPR: A game-changing genetic engineering technique.”
Broad Institute: “Questions and Answers About CRISPR.”
Nature: “Gene-edited ‘micropigs’ to be sold as pets at Chinese institute,” “What
CRISPR-baby prison sentences mean for research,” “Russian ‘CRISPR-baby’ scientist
has started editing genes in human eggs with goal of altering deaf gene.”
Oregon Health & Science University: “OHSU performs first-ever CRISPR gene editing
within human body.”
UC Berkeley: “CRISPR reduces autism symptoms in mice.”
National Organization for Rare Disorders: “Duchenne Muscular Dystrophy.”
Victoria Gray, Forest, MS.
Haydar Frangoul, MD, medical director of pediatric hematology/oncology, HCA
Healthcare’s Sarah Cannon Research Institute and The Children’s Hospital At TriStar
Centennial, Nashville.
Eric Olson, PhD, professor and chair, Department of Molecular Biology, UT
Southwestern Medical Center.
Insoo Hyun, PhD, director of research ethics, Center for Bioethics, Harvard Medical
School.
Debra Miller, founder, CureDuchenne.
Science: “Gene editing restores dystrophin expression in a canine model of Duchenne
muscular dystrophy.”
New England Journal of Medicine “CRISPR-Cas9 Gene Editing for Sickle Cell Disease
and β-Thalassemia.”
News release, University of California San Francisco.
Lisa Marshall, May 2021
Trân trọng cảm ơn!